Science/Research 詳細
アルツハイマー病治療の新たな標的を発見
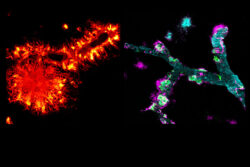
December, 21, 2022, Bonn--タンパク質メディンは、タンパク質アミロイド-βとともにアルツハイマー病患者の脳の血管に蓄積される。DZNE(神経変性疾患ドイツセンタ)の研究者は、このいわゆる共凝集を発見した。成果は、Natureに発表された。
「メディンは、20年以上前から知られていたが、以前は病気へのその影響は過小評価されていた。われわれは、アルツハイマー病患者の血管の病理学的変化が、メディンによって著しく強められることを示すことができた」とDZNEのTübingenサイト、 D. Jonas Neherは、コメントしている。同氏は、この研究のリーダー。チュービンゲンの臨床脳研究Hertie Institute、チュービンゲン大学(University of Tübingen)、複数の国際研究機関と協力パートナーも、この長期プロジェクトに関わっている。
メディンは、アミロイドグループに属する。これらタンパク質の中で、アルツハイマー病患者の脳に凝集するので、アミロイド-βが最もよく知られている。これらの凝集は、いわゆるプラークとして脳組織に直接蓄積するとともに血管にも蓄積するので、そこでは、それぞれ神経細胞と血管に損傷を与える。しかし、多くの研究はアミロイド-βに焦点を合わせており、メディンは関心の的ではなかった。「すなわち、メディンに関連する臨床的病理学的に目立つ証拠はほとんどなかった。その点は、アミロイドをもっと徹底的に研究するための必須条件となることがよくある」とJonas Neherは、説明している。
しかし、メディンは実際、50歳以上の人にはほぼ誰にでも血管に見つかるので、最も一般的な既知のアミロイドとなっている。この研究チームで、Jonas Neherは、メディンが年取ったマウスではなおさら発達することを独自に見出し、この発見を2年前に科学誌PNAS (DOI: 10.1073/pnas.2011133117)で報告した。マウスが年取っていればいるほど、その脳血管にメディンはますます多く蓄積する。これが、当時の発見であった。さらに、脳が活性化し、血液供給の増加を始動すると、メディン蓄積の血管は、メディンが存在しない血管よりもゆっくりと拡大する。しかし、血管のこの.機能は、脳に酸素や栄養素を適切に供給する上で重要である。
最新の研究成果で、研究チームは、この根拠に基づいて特にアルツハイマー病に注目した。まず、アルツハイマー病のマウスモデルで、アミロイド-β蓄積も存在すると、メディンが脳血管に極めて強く集積することを示すことができた。重要なことは、アルツハイマー病認知症の臓器ドナーからの脳組織が分析されて、これらの結論が確認されたことである。しかし、マウスが、メディン形成を阻止するように遺伝子改変されていると、アミロイド-β蓄積の発展は著しく少なく、結果的に血管損傷は少なかった。
Jonas Neherによると、メディンに取り組んでいる研究グループは、世界中にほんの一握りである。ごく最近、USの研究が、メディンレベルがアルツハイマー病患者で増加する可能性を報告した。しかし、この増加が単に病気の結果なのか、それとも原因の一つかどうかは明らかにされないままである。「われわれは、現在、アルツハイマー病モデルで、メディンが実際に血管病変を促進することを多くの実験で示すことができた。これは、メディンが、病気の原因の一つであること示唆している」(Neher)。
研究では、研究チームは、特殊なタンパク質が見えるように、マウスとアルツハイマー病患者の両方からの組織部分を染色した。これにより、メディンとアミロイド-βが脳の血管に共に蓄積していることを示すことができた。次のステップで、これら2つのアミロイドが共凝集していることを証明できた。すなわち、混合蓄積の形成である。「驚いたことに、メディンは、アミロイド-βと直接相互作用し、その凝集を促進する、これは全く知られていなかった」とJonas Neherは、結果をまとめている。
研究者が新たな治療の開発の望みを引き出したのは、正にこの洞察からである。「メディンは、血管損傷、脳の血管におけるアミロイド蓄積から来る認知低下を防ぐための治療標的となりうる」と研究者は結論づけている。脳組織におけるアミロイド-β凝集に加えて、アルツハイマー病の進行が血管の変化によって促進されることは議論の余地がない。すなわち、機能低下、つまり血管損傷である。したがって、病変を標的にするだけでなく影響を受けた血管を標的にする治療が患者に役立つ。
次のステップでは、メディン凝集が治療的に除去できるか、この介入が実際に認知パフォーマンスに効果があるかどうかを判断する必要がある。研究者は、まずマウスモデルでこれをテストすることを考えている。これらが、アルツハイマー病患者で病理学的変化をよく反映しているからである。
(詳細は、https://www.dzne.de)














