Pick up magazine feature 詳細
2光子顕微鏡法によるバイオ研究の進歩
September, 5, 2023--ジョセフ・マストロン
2光子レーザ走査型顕微鏡法を対象とした数十年間にわたる研究によって、in vivoの神経活動を3次元で測定するための新たな手段が、神経科学者らにもたらされている。
2光子顕微鏡法にはここ数年で多数の進歩があった。例えば、遺伝的に符号化された新しい蛍光センサ、空間情報を時間で多重化する測定方法、大きな範囲や複数の範囲を同時に観察できる顕微鏡などである。
超短パルスレーザは世代ごとに新たな進歩をもたらす。その最も顕著な例が、第1世代の超短レーザパルスを実現した、衝突パルスモード同期(colliding-pulse mode-locking:CPM)色素レーザである。生物物理学者のワット・ウェッブ氏(Watt Webb)は1980年代初頭に、物理学者のウィンフリード・デンク氏(Winfried Denk)とジェームス・ストリクラー氏(James Strickler)とともに、世界初の2子蛍光顕微鏡を発明した。デンク氏はその10年後、再生チャープパルス増幅システムを使用して、高出力の超短パルスによるイメージングの深度を1mm以上にまで拡大した。現在はチューナブルなチタンサファイア(Ti:sapphire)発振器が、市場の最先端として存在する。
ここ数年の間に登場した、次世代の固定波長ファイバレーザ技術も例外ではない。これらの進歩は、超小型顕微鏡やモバイル設定など、新しい種類の測定を可能にする。
2光子顕微鏡法のメリット
2光子イメージングは、蛍光イメージングの1種である。可視光によって直接励起する代わりに、近赤外(near-IR)光による蛍光標識の2 光子励起を使用する。アッベ回折限界のスポット径は近赤外領域では大きくなるが、2光子吸収過程は、光強度に対して線形ではなく、その二乗に比例する。
蛍光の励起と発光は、標準的な蛍光イメージングのような円錐状の励起領域ではなく、焦点体積に限定される。この小さな焦点体積によって、単光子の場合よりもはるかに高い深度分解能が得られ、レゾナントガルバノスキャナや音響光学素子によるサンプル全体の走査が可能である。2光子顕微鏡は、複数の深度スライスを走査することによって、画像を3次元で収集することができる。また、近赤外光は組織を透過する際の散乱が可視光よりも低いため、2光子顕微鏡法は、遺伝的に符号化されたセンサと組み合わせて、in vivoイメージングに用いられることが多い。
ファイバレーザ技術の次世代用途
2光子顕微鏡法用の(ウェッブ氏らが開発した)最初の装置は、机ほどのサイズだったが、今ではわずか3gにまで小型化されている。連続波ミニスコープ(小型顕微鏡)は、その発明から10年以内に2光子深度イメージング用に改変され、2光子イメージングレーザのフットプリントは現在、大きな辞書よりも小さくなっている。
ノルウェーのカブリ研究所(Kavli Institute)のモーザーグループ( Moser group)に所属する研究者であるウェイジャン・ゾン氏( Weijian Zong)は、2017年から2光子顕微鏡法の小型化に取り組んでいる。同氏は、それまでの2光子ミニスコープを拡張して、3gのヘッドマウント顕微鏡「MINI2P」を開発した。これまでよりも格段に広い視野を持ち、自由に動き回るマウスの複数の焦点面内にある最大1000個の神経細胞を撮影することができる(図1)(1)。

図1 3gの超小型ヘッドマウント2光子顕微鏡「MINI2P 」
マイクロオプティクスは、この小型化において非常に大きな役割を担っており、可変焦点用にMEMS圧電素子の4重レンズ、ラスタ走査用にMEMSスキャナが採用されている。MINI2Pのこれまでの世代には、最大限のパルス品質と画質を実現するために、チタンサファイアシステムが採用されていたが、それがこの研究用装置のモビリティを制約する要因になっていた。MINI2Pプロジェクトにおいてゾン氏は、このファイバ接続の顕微鏡を、登り壁があるケージや迷路など、さまざまな環境で使えるようにしたいと考えた。そこで同氏は、モバイルカートを構築し、市場で提供されているものの中から、パルスペデスタルやウィングがない最高品質のsech2パルスを提供するものとして、独トプティカ社のファイバレーザ「FemtoFiber Ultra 920」を選択して、このカートに搭載した。
同氏は920nmのレーザ出力をMINI2P顕微鏡にファイバ結合することにより、環境内を自由に動き回るマウスの中の遺伝的に符号化されたGCaMP(カルシウムに反応して神経活動を示す蛍光タンパク質)を撮影した。頭部を固定したマウス(発泡スチロールの玉の上を歩き回っている場合もある)に、コンピュータ画面の仮想現実環境を見せて撮影するという設定も存在する。しかし、その設定では、登ったり跳ねたりといった活動時のマウス脳を観察する能力が制限される。 MINI2P顕微鏡によって研究者は、そうした行動を直接調査することが可能となり、行動と細胞レベルの認識の相関に関する新たな次元の洞察を得ることができる。
皮膚科における2光子顕微鏡法の利用—組織検査結果を即日確認
米ロチェスター大(University of Rochester)のマイケル・ジャコメリ氏(Michael Giacomelli)は、2光子顕微鏡技術を皮膚科医院の即日検査に適用している。研究室に入って最初に目に入るのが、同氏のはんだ付け装置である。ジャコメリ氏のグループはこの場所で、その顕微鏡の中核となる次世代シリコン光電子増倍管(PMT)検出器を開発した。この検出器は、2光子顕微鏡法で従来使われているPMT検出器の約9倍の信号雑音比を備える(2)。この技術を利用することにより、サンプル全体の画像を驚くほど高速に収集することができる。顕微鏡のスライド上に配置された1cm2ほどの洗浄済みの組織サンプルの全体を、30秒未満で細胞内の細部まで完全に撮影することができる(3)。撮影しているのは細胞片であって、生きたマウスではないため、熱損傷を心配する必要はない。輝度を上げることによって信号雑音比を最大化し、数百枚もの2光子画像をつなぎ合わせて、cmサイズのズーム可能な画像を生成することが可能である(図2)。
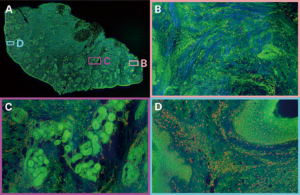
図2 ジャコメリ氏のグループによる組織のハイパースペクトル画像。(a)は、組織サンプルのcmサイズの2光子画像の全体図。蛍光染色(タンパク質:緑、DNA:赤)とSHG(コラーゲンSHG:青)からの信号を使用した擬色RGB画像である。(b)はコラーゲンが豊富な領域。(c)はタンパク質が豊富な領域。(d)はDNAが豊富な領域で、血管に隣接する多くの細胞核が示されている。画像は、トプティカ社のFemtoFiber Ultra 920レーザを2光子励起に使用することによって収集されている
イメージング処理で収集された異なるスペクトルチャンネル、SHG(コラーゲンや結合組織内など)を含む信号、細胞の異なる部分(細胞体や神経核など)に結合した蛍光色素の発光に人工的に色付けをすることにより、皮膚科医が100年前から使用してきた組織染色に似た画像を生成することができる(図3)。さらに、カートに搭載されたジャコメリ氏の顕微鏡を使用すれば、処理と画像生成のためにサンプルを検査施設に送付する必要はない。皮膚科医は院内でそれを行い、組織検査の結果をその日に得ることができる。
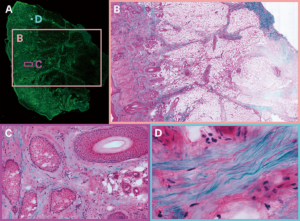
図3 ジャコメリ氏のグループによる組織のハイパースペクトル画像。(a)は、組織サンプルのcmサイズの2光子画像の全体図。(b)〜(d)は、蛍光染色(細胞体:ピンク、神経核:紫)とSHG(コラーゲンSHG:青)からの信号を使用して、組織染色を模倣した擬色画像である。(b)には、多様な特徴を持つサンプルの広い領域が示されている。(c)は、血管などの多様な種類の組織を示す領域。(d)はコラーゲンが豊富な領域。画像は、トプティカ社のFemtoFiber Ultra 920レーザを2光子励起に使用することによって収集されている
マルチカラーのin vivoイメージング
米コーネル大(Cornell University)のMeinig School of Biomedical Engineeringに在籍する研究者であるクリス・シャファー氏(Chris Schaffer )とノゾミ・ニシムラ氏は、一般的な単光子や2光子ではな く、波長800、900、1030nmの3つのレーザ源を励起に使用するハイパースペクトル多光子顕微鏡を開発した。角度を調整可能なバンドパスフィルタの4つの異なる位置によって、4チャンネルを同時に検出することができ、合計16個の異なる波長における蛍光検出が可能である。1枚の2光子画像につき、合わせて48チャンネルの情報を収集する。それぞれの蛍光染色の既知のスペクトルに基づいてこれらのチャンネルに線形変換を適用することにより、最大10種類の異なる色素と、同じイメージングボリュームの中の最大8種類の異なる組織を解像可能であることが実証されている(4)。
この種の測定の1つのボトルネックは、3つの励起レーザ源の同期と、それらの間の切り替えである。各レーザによってシーケンシャルにin vivoイメージングを行う場合、画像の収集に費やされる時間の間に、筋肉のけいれんや血管の脈動など、サンプルの変化が生じる可能性があり、それらの画像の収集と変換は難しくなる。レーザパルスのインターリーブや光学的同期は、その明らかな解決策である。
ファイバレーザ技術の進歩
トプティカ社のファイバレーザは、この分野の進歩の一例である。通信コンポーネントによって構築されており、モード同期エルビウムファイバ発振器によって生成された、高品質でクリーンなレーザパルスがシード光として同社独自の周波数シフト及び増幅モジュールに供給される。
クリーンパルス技術と100fsのsech2パルスにより、平均出力に対して最大のピーク出力と最高の画像輝度が、2光子顕微鏡法の用途に対して提供される。また、同じ発振器技術を780、920、1050nmのレーザシステムに適用することにより、同一発振器のシードを最大4つの光学同期レーザへ簡単に分岐し、0〜12.5nsの固定遅延、インターリーブパルスの場合は最大500psの可変遅延を実現することができる。このレーザシステムは、光学テーブル上に配置されるレーザヘッドを除くと、オールファイバで光を伝搬するため、サービス契約や年に2 回のメンテナンスは不要である。
参考文献
(1)W. Zong et al., Cell, 185, 1240(2022).
(2)V. D. Ching-Roa, E. M. Olson, S. F. Ibrahim, R.Torres, and M. G. Giacomelli, Sci. Rep., 11, 5248(2021).
(3)V. D. Ching-Roa, C. Z. Huang, S. F. Ibrahim, B. R. Smoller, and M. G. Giacomelli, JAMA Dermatol., 158, 1175
(2022).
(4)A. J. Bares et al., Optica, 7, 1587(2020).
著者紹介
ジョセフ・マストロン(Joseph Mastron)は、独トプティカ・フォトニクス社の米国法人に所属する超高速アプリケーションサイエンティスト。
e-mail:joseph.mastron@toptica-usa.com
URL:www.toptica.com




















