Science/Research 詳細
POSTECH、脳の神経を破壊する毒物の構造を解明
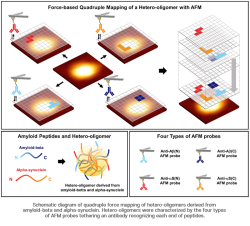
August, 11, 2021, Pohang--アルツハイマー病では、ニューロンの変形や死によって記憶や認知機能が徐々に低下する、またパーキンソン病は、手や腕の震えの原因であり、正常な動きを妨げる。これらは主要な神経変性疾患である。最近、POSTECH(浦項工科大学校)の研究チームが、アルツハイマー病やパーキンソン病の同時発生因となる物質の構造を特定した。
POSTECH化学部、Joon Won Park教授とPh.D. 候補 Eun Ji Shinのチームが、アルツハイマー病とパーキンソン病に見つかったヘテロオリゴマーの表面構造を調べた。その構造の特定にはAFMを使った。研究成果は、Nano Lettersのフロントカバーストーリー論文となっている。
アルツハイマー病とパーキンソン病の病理学的重複は、アミロイドベータとα-シヌクレイン由来のヘテロオリゴマの形成に関連している。しかし、その構造の観察に技術的な制約があることから、処置の研究が難しかった。
これに対して研究チームは,AFMを使って、アルツハイマー病のバイオマーカーとして知られるアミロイドベータ由来ヘテロオリゴマ、パーキンソン病のバイオマーカーとして知られるα-シヌクレインのナノ凝集体の表面特性を単一分子レベルで観察した。
研究チームが、各ペプチドのN末端あるいはC末端を認識する抗体で固定された4つのAFM先端で調べると、全ての凝集体がヘテロオリゴマであることが確認された。加えて、ヘテロオリゴマの場合、ペプチド末端を認識する確率が、ホモオリゴマよりも高いことが確認された。
この結果が示唆するところは、各ペプチド末端が、ホモオリゴマよりもヘテロオリゴマ表面に見つかる傾向が大きいことである。即ち、その表面上のペプチド末端は、自由度が大きい。つまり、ペプチド凝集体は、ホモオリゴマよりもヘテロオリゴマに緩やかに充填されていることが認められる。
この研究は、変性タンパク質ナノ凝集体の構造を観察する初めての研究であり、以前に確認されたことはなかった。観察には、4 先端の4重マッピングを利用。ヘテロオリゴマ凝集体の検証は、実験基盤として役立つ。それは、アルツハイマー病やパーキンソン病以外の様々な神経変性疾患の重複現象に関連する研究でも利用可能である。
「これまで、ナノ凝集体を分析する十分な方法はなかったので、異種凝集体構造的同一性を解明することはできなかった」(Joon Won Park教授)。「この研究で開発された分析法は、他のタンパク質凝集体に適用できるので、アルツハイマー病あるいは狂牛病などの病気の原因特定に役立つ」と同教授は話している。
(詳細は、https://www.postech.ac.kr)




















