Science/Research 詳細
生きたマウスで初の3D超分解能画像取得
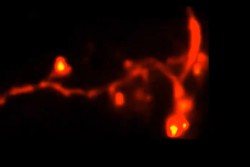
April, 6, 2021, New Haven--イェール大学医学大学院(Yale School of Medicine)の研究チームは、新しい顕微鏡技術を開発した。これは、脳を含む、生体組織深部約100µmから細胞下構造の3D超解像画像を取得できる。研究者が脳深部を見ることができるのでその方法は、研究中、あるいは病気の結果としてニューロンに徐々に起きる微妙な変化を明らかにする際に役立つ。
その新しいアプローチは、誘導放出抑制顕微鏡(STED)の拡張である。これは、従来の光学顕微鏡の回折限界を克服することでナノスケールの解像度を達成したブレイクスルー技術。Stefan Hellは、この超解像度イメージング技術開発で2014年にノーベル化学賞を受賞した。
Opticaでは、研究チームは、新しいSTED顕微鏡をどのように使って生きたマウスの脳深部内の樹状突起スパインの3D構造を超分解能で撮像したかを説明している。樹状突起スパインは神経の樹状分岐の微小な突起であり、これは隣接ニューロンからのシナプス入力を受ける。神経活動で重要な役割を果たす。
「われわれの顕微鏡は、生きた動物の深部で3D STED超分解能を達成した世界初の装置である。深部組織イメージング技術におけるそのような進歩により、研究者は、ネイティブ組織環境で細胞下構造と動力学を直接可視化できる。この方法で細胞の挙動を研究できることは、製薬や生体医用研究で生物学的現象の包括的な理解に重要である」と、イェール大学、研究チームリーダー、Joerg Bewersdorgはコメントしている。
さらに深く
従来のSTED顕微鏡は、培養細胞標本を撮像するために非常によく使われている。その技術を使って厚い組織あるいは生きた動物を撮像するのは、かなり難しい。特にSTEDの超分解能の利点が3D-STEDで3次元に拡張される場合である。この限界が起きるのは、厚くて光学的に密な組織のために光が深く浸透せず、適切に焦点を合わせることができないからである。したがって、STED顕微鏡の超解像能力が損なわれる。
この問題を克服するために研究チームは、STED顕微鏡と2光子励起(2PE)、補償光学を組み合わせた。「2PEは、可視光ではなく近赤外光を利用することで組織深部のイメージングを可能にする。近赤外光は、散乱の影響を受けにくいからである。したがって、組織深部への浸透が改善される」と論文の筆頭著者、Mary Grace M. Velascoは説明している。
研究チームは、システムに補償光学も加えた。「補償光学の利用は、光の形状歪、つまり光収差を補正する。歪は、組織内部に透過してイメージングするときに生ずる。イメージング中、補償素子は光波面を試料の組織が変更するのと正反対に修正する。したがって、補償素子からの歪が、組織からの収差を相殺し、理想的なイメージング条件を形成する。これによりSTED超分解能は、全3次元で回復される」とVelascoは説明している。
脳の変化を見る
チームは、その3D-2PE-STED技術をテストした。まず、カバースリップ上の特徴がはっきりした培養細胞をイメージングした。2PEだけを使う場合と比較して、3D-2PE-STEDは、1/10以下の小さなボリュームを解像した。チームは、その顕微鏡が、従来の2光子顕微鏡と比べて、マウス皮膚の細胞核のDNA分布を非常によく解像できるとを示した。
これらのテスト後、チームはその3D-2PE-STED顕微鏡を使って、生きたマウスの脳をイメージングした。樹状突起スパインの一部にズームインし、個々のスパインの3D構造を解像した。次に、同じ領域を2日後撮像し、そのスパイン構造が、この間に確かに変化していたことを示した。研究者は、その画像におけるニューロンの構造にいかなる変化も観察しなかった。あるいは、イメージングからの損傷を示すと考えられるマウスの挙動でも変化はみられなかった。しかし、チームは、これをさらに研究する計画である。
「樹状突起スパインは非常に小さいので、超解像がなければ、その正確な3D形状を可視化すること難しい。言うまでもなく、時間経過でこの形状におけるどんな変化も可視化は困難。3D-2PE-STEDは、これらの変化を見る手段を提供する。脳の表層だけでなく、一層興味深い接続が起きる脳深部も観察する」とVelascoはコメントしている。




















