Science/Research 詳細
侵攻性ガンのプロトン治療効果研究に3D共培養モデル
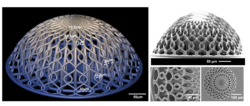
December, 20, 2023, Delft--デルフト工科大学(TU Delft)の研究者は、脳の微小血管系の形状に触発された新しい3Dエンジニアリング・スカフォールド(構造)を設計した。
微細構造は、侵攻性の脳腫瘍である神経膠芽腫(グリオブラストーマ)と、血管の構成要素である内皮細胞の両方と共培養された。このモデルにより、研究者はグリオブラストーマに対する陽子線(プロトン)治療の効果を研究し、ガン細胞に対する内皮細胞の保護的役割の可能性を明らかにした。
「腫瘍は、主に2D環境(ペトリ皿など)または動物実験によって研究される。これらのモデルは何マイルも離れているため、2Dモデルから得られた知見を人間のコンテクストに変換することは非常に困難である。その上、実験動物の使用には明らかな倫理的影響がある」と、精密・マイクロシステム工学科の助教授、Angelo Accardoは話している。Accardoは、in vitro(細胞)モデルとin vivo(生体)モデルのギャップを埋めることを目指している。Accardoは、博士課程学生、Qais Akolawala、Holland Proton Therapy Center(HollandPTC)およびLUMCの共同研究者とともに、脳の微小血管構造に似た3Dエンジニアリングの構造を開発し、プロトン治療が膠芽腫に及ぼす影響の理解を深めることに貢献した。
巻き添え被害の最小化
細胞は、外部環境、特に環境の形状に対して振る舞い、応答することが示されている。「生物学的に関連性のあるモデルを作成するには、自然環境を可能な限り模倣した3Dエンジニアリングの構造が必要になる。グリオブラストーマは脳の血管の周囲に集まって増殖するため、モデルでは小さな血管と湾曲を設計した」(Akolawala)。
研究チームは、2光子重合として知られる微細製造技術を用いて、これらの工学的微小環境を作製した。まず、血管を覆う細胞である内皮細胞を、製造した微細構造上に培養し、次にヒトの悪性グリオブラストーマ細胞を培養した。
グリオブラストーマは、予後不良の非常に侵攻性のガン。手術、化学療法、X線放射線療法が現在の標準となっているが、プロトンビーム治療は、周囲の健康な組織を温存しながらガン細胞に損傷を与えることができるため、魅力的な代替手段である。Accardo:「これは、プロトンが細胞損傷を引き起こすエネルギーを、患者の体内の特定のポイントで放出できるからである」
プロトン治療はX線に比べて比較的新しい技術であるため、生理学的に関連する微小環境内でのプロトン細胞間相互作用と、それが実際にガン細胞にどの程度の損傷を与えるかについて、さらに理解を深める必要がある。
プロトン放射線生物学のための「工学的」ベンチマークツール
新しい3Dモデルはこれに貢献できる。「われわれの3Dモデルでは、プロトンがグリオブラストーマ細胞に誘導するDNA損傷は、2Dモデルと比較してin vivoモデルで報告された損傷と著しく類似していることが観察された」(Accardo)。
さらに、内皮細胞で培養したグリオブラストーマ細胞は、グリオブラストーマ細胞のみで培養したモデルよりもDNA損傷が少なく、内皮細胞がグリオブラストーマ細胞の放射線耐性に関与していることが示された。「われわれは、内皮細胞が生化学的相互作用を介してグリオブラストーマ細胞に対して保護的な役割を担っているか、または内皮細胞が脳腫瘍細胞の幹細胞性を高め、それが攻撃性のレベルに影響を与えるという仮説を立てている」とAccardoは話している。
Advanced Healthcare Materials誌に掲載されたこの研究は、3Dモデルが生理学的に関連性があり、再現性があることを示した。
「われわれの次のステップは、患者由来の細胞にアプローチを拡張し、陽子線の他のモダリティ(FLASHなど)をテストすることである」
Accardoの最終的な目標は、この3Dモデルを使用して、患者由来の細胞の放射線に対する応答を調べ、個別化された治療戦略の実現への道を開くことである。














