Science/Research 詳細
分子ジャックハンマーの「良い振動」がガン細胞を根絶
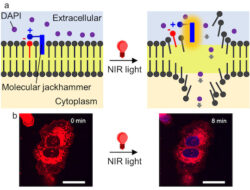
January, 19, 2024, Houston--光による全分子振動はメラノーマ細胞の膜を破裂させる可能性がある。
ビーチ・ボーイズの象徴的なヒット・シングル“Good Vibrations”は、まったく新しい意味を持つようになった。ライス大学の科学者と共同研究者が最近発見したことで、光に刺激されると一部の分子が強く振動する能力を利用してガン細胞を破壊する方法を発見したからである。
研究チームは、医用画像に使用される小さな色素分子の原子が、近赤外光によって刺激されると一斉に振動し、プラズモンと呼ばれるものを形成し、ガン細胞の細胞膜を破裂させることを発見した。Nature Chemistry に掲載された研究によると、この方法はヒトメラノーマ細胞の実験室培養に対して99%の効率を示し、メラノーマ腫瘍のマウスの半数は治療後にガンがなくなった。
「これは、われわれが分子ジャックハンマーと呼ぶ、まったく新しい世代の分子マシーンだ」と、感染性細菌、 がん細胞、治療抵抗性真菌の外膜を突き破るために、同じ方向に連続的に回転する光で活性化されたパドル状の原子鎖を備えたナノスケールの化合物を使用したことがあるライス化学者、James Tourは話している。
ノーベル賞受賞者のBernard Ferigaの分子モーターをベースにしたナノスケールのドリルとは異なり、分子ジャックハンマーは全く異なる前例のないメカニズムを採用している。
「従来のフェリンガ型モーターの100万倍以上の機械的動作が可能で、可視光線ではなくNIR光で作動させることができる」(Tour)。
NIR光は、可視光線よりもはるかに深くまで浸透し、組織を傷つけることなく臓器や骨にアクセスすることができる。
「近赤外光は、可視光の透過深度である半㎝(~0.2インチ)ではなく、人体の奥深くまで10㎝(~4インチ)まで届く可能性がある。これは、ナノドリルを活性化するために使用した」と、ライス大学のT.T.とW. F. Chao化学教授、材料科学とナノ工学の教授であるTourは説明している。「これは大きな進歩である」
ジャックハンマーはアミノシアニン分子で、医用画像に使用される蛍光合成染料の一種。
「これらの分子は、人々が長い間使用してきた単純な染料である。生体適合性があり、水中で安定しており、細胞の脂肪質の外層に付着するのが非常に得意。しかし、イメージングに使われていても、プラズモンとして活性化する方法はわかっていなかった」と、この研究の筆頭著者であるライスの研究科学者であるCiceron Ayala-Orozcoは話している。
Ayala-Orozcoは当初、ライス大学のNaomi Halasが率いる研究グループの博士課程学生としてプラズモンを研究していた。
「これらの分子の構造と化学的性質により、これらの分子の核は、適切な刺激にさらされると同期して振動することができる。プラズモンの特性を治療の一形態として利用する必要性を感じ、ガン細胞を扱うためのDr Tourの機械的アプローチに興味を持った。基本的には点と点をつないだ」(Ayala-Orozco)。
「われわれが特定した分子プラズモンは、片側にアームがあるほぼ対称的な構造をしている。アームはプラズモニック運動には寄与しないが、分子を細胞膜の脂質二重層に固定するのに役立つ」。
研究チームは、分子の作用メカニズムが光線力学療法と光熱療法のいずれにも分類できないことを証明しなければならなかった。
「強調する必要があるのは、これらの分子がどのように機能するかについて、別の説明を発見したということである。分子プラズモンがこのように利用されて分子全体を励起し、特定の目的(この場合はガン細胞の膜を引き裂く)を達成するための機械的作用を実際に生み出すのは初めてである」(Ayala-Orozco)。
「この研究は、分子スケールで機械的な力を使ってガンを治療する別の方法に関するものである」
量子化学者で化学工学の教授であるJorge Seminarioが率いるテキサスA&M大学の研究者は、ジャックハンマー効果に関与する分子の特徴について、時間依存の密度汎関数理論分析を行った。ガン研究は、テキサス大学MDアンダーソンガンセンタで、頭頸部外科の教授兼学科長、外科部門のトランスレーショナルリサーチディレクタ、Dr Jeffrey Myersと共同でマウスで実施された。














