Business/Market 詳細
EIT 3Dプリントチタンケージ、FDA認可取得
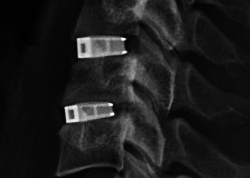
July, 26, 2017, Geelong--Emerging Implant Technologies GmbH (EIT)、ドイツの医療デバイスメーカーは、積層造形を利用することで脊椎アプリケーション向けの画期的な技術の実現だけに集中してきた。EITは、ALIF, TLIF, PLIF および頸部処置向けの脊髄椎体間製品を商用化するための全面的承認を米国食品医薬品局(FDA).から得た。
EIT Cellular Titaniumは、多孔性チタン構造であり、骨内部成長を最適化する理想的な細孔形状とサイズについての科学的な洞察にしたがって設計されている。金属3Dプリンティング選択的レーザ溶解(SLM)技術および独自の後処理法を利用できるため、骨結合のために高度に多孔質で、骨に影響を及ぼすチタンスカフォールドを造ることが可能になった。このEIT Cellular Titanium構造は、ALIF, TLIF, PLIF および頸部インプラントライン全部に適用されており、臨床事例研究と修正分析が短い時間フレームで、頸部および腰椎の全インプラントで広範な骨の内部成長を実証している。
EIT Cellular Titanium椎体間ケージは、骨に影響するスカフォールドと脊椎整合に対処する設計とを統合するSmart Spinal Fusionをターゲットにしている。インプラントは、ドイツ、フランス、オーストラリア、韓国、オランダを含む15カ国以上で10000を超える事例で使用されている。この510(k)認定取得で、EITは、ただちに全面的商用化に乗り出す。














