Science/Research 詳細
レーザがCryo-EMの時間分解能を改善
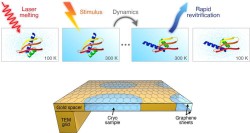
July, 26, 2021, Lausanne--EPFLの研究者は、クリオ電子顕微鏡(Cryo-EM)のリアルタイム観察力を高速化できる新方法を考案した。
2017年、Jacques Dubochet、Joachim Frank、およびRichard Hendersonが、Cryo-EMへの貢献でノーベル化学賞を受賞した。これは、原子精度でタンパク質など生体分子の画像を撮ることができるイメージング技術。
Cryo-EMでは、サンプルはガラス状の氷に埋め込まれている。氷のガラスのような形式で、水が結晶化できないほど急速に凍らされると得られる。ガラス化されたサンプルで、その分子構造の高解像度画像が、電子顕微鏡で得られる。この顕微鏡は光の代わりに電子ビームを使って画像を形成する装置。
Cryo-EMは、ライフサイエンス、化学および医学に新たな次元を開いた。例えば、最近では、COVID-19ワクチンの多くのターゲットであるSARS-CoV-2スパイクタンパク質の構造マッピングに利用された。
タンパク質は、細胞内で絶えずその3D構造を変えている。これら立体再配置は、タンパク質がその特殊機能を実行するには不可欠であり、これは、1秒の数百万分の1から数千分の1に起こる。そのような高速の動きは、速すぎて現在のCryo-EMプロトコルではリアルタイム観察できないので、われわれのタンパク質理解は不完全である。
しかしEPFL基礎科学部、Ulrich Lorenzをリーダーとするチームは、タンパク質の動きをマイクロ秒で撮ることができるCryo-EM法を開発した。研究成果は、Chemical Physaics Lettersに発表された。
その方法は、レーザパルスでガラス化サンプルを急速溶解する必要がある。氷が液体中に溶け込むと、チューナブル時間ウインドウがあり、そこでタンパク質は、細胞内で自然の液体状態で動くように誘導可能になる。
「一般的に言えば、クライオサンプルを温めると、それは非ガラス化する。しかしわれわれは、そのサンプルを極めて迅速に溶かすことで、この障害を克服した」とUlrich Lorenzは説明している。
レーザパルス後、サンプルは、わすが数マイクロ秒で再ガラス化され、その過渡的構成に粒子をトラップする。この「休止」状態で、粒子は従来のCryo-EM法で観察可能になる。
「Cryo-EMの時間分解能をタンパク質の自然のタイムスケールに一致させることで、われわれは、以前にはアクセスできなかったプロセスを直接研究することができる」と同氏は説明している。
研究チームは、構造的にタンパク質に損傷を与えた後に、タンパク質を分解することで、その新方法をテストした。さらに、部分的に解明された構成にタンパク質をトラップした。
(詳細は、https://actu.epfl.ch)


















