Pick up magazine feature 詳細
神経科学
December, 10, 2021--脳への窓を開く光学ツール
リチャード・ゴーハン
ブレイン・マシン・インタフェースは、生理学と認知の基本的な関係だけでなく、神経病理や神経可塑性などの研究にも役立っている。
神経シグナルを外部デバイスに接続する機器であるブレイン・マシン・インタフェース(BMI)は義肢装具を制御し、逆に外部デバイスからの信号を脳に伝達して解釈させることもできる。理想的なBMI は双方向のコミュニケーションを可能とし、感覚のフィードバックと運動の制御が同時に起こる生体脳の閉ループ性能を模倣する。
光技術は高速で比較的侵襲性が低く、互いに干渉したり電気信号に影響を与えたりすることがないため、より高性能なBMI を実現する鍵となる。BMIは当初、神経学の知見を実用化するための手段として考案された。しかしながら現在では、神経可塑性や神経病理、生理学と認知の基本的な関係について知見をもたらしている(1)。BMI 技術はさまざまな面で急速に発展しており、より高速なデータ伝達、より微細な操作、全く新しい機能の実現が可能となっている。
スピードを上げる
将来の植込み型デバイスは、高密度に配列された単一ニューロンの信号を検出できるかもしれないが、そのデータをどう伝送すべきだろうか。伊ラクイラ大(University of L ’ Aquila)と英インペリアル・カレッジ・ロンドン(Imperial College London)のアンドレア・デ・マルセリス教授(Andrea De Marcellis)らは、超広帯域パルスデータコーディングに着想を得て、植込み型バイオテレメトリー機器に光通信を導入しようと検討した(2)。デ・マルセリス教授は、このアプローチによって、「電磁干渉がなく、高いデータ伝送速度と低消費電力」ともたらすと述べる。
研究チームは、850nmのVCSELトランスミッタと、直径250μmで応答速度47psの光ダイオードを高ゲインアンプに接続したシステムを設計した。レーザの出力を上げずに伝送エラーを最小限に抑え、また組織の熱ダメージを避けるため、同期オンオフキー変調を実装した。これにより、クロック信号とデータ信号を組み合わせて、迅速かつ自動的にデータ整合性を維持できる。
この方式を検証して最適な動作パラメータを探すため、厚さ3.5mmのブタの皮膚の内側にVCSELを設置し、反対側に光検出器を置き、神経シグナルを伝送するシミュレーションを実施した(図1)。300MHzで900psパルスを照射し、平均光出力を2mW以下にすると、ビット誤り率は10-10以下、総電力消費量は11mW以下であるシステムであると実証された。 デ・マルセリス教授のチームは、このプロトコルをASICシステムオンチップ(SoC)に実装し、現在はミスアライメント耐性を向上させ、必要電力を削減するために、オプトエレクトロニクスソリューションを研究している(3)。
「我々の光学バイオテレメトリーはブレイン・マシン・インタフェースなど、非常に拡張性の高い植込みデバイスに特に適している」と同教授は言う。
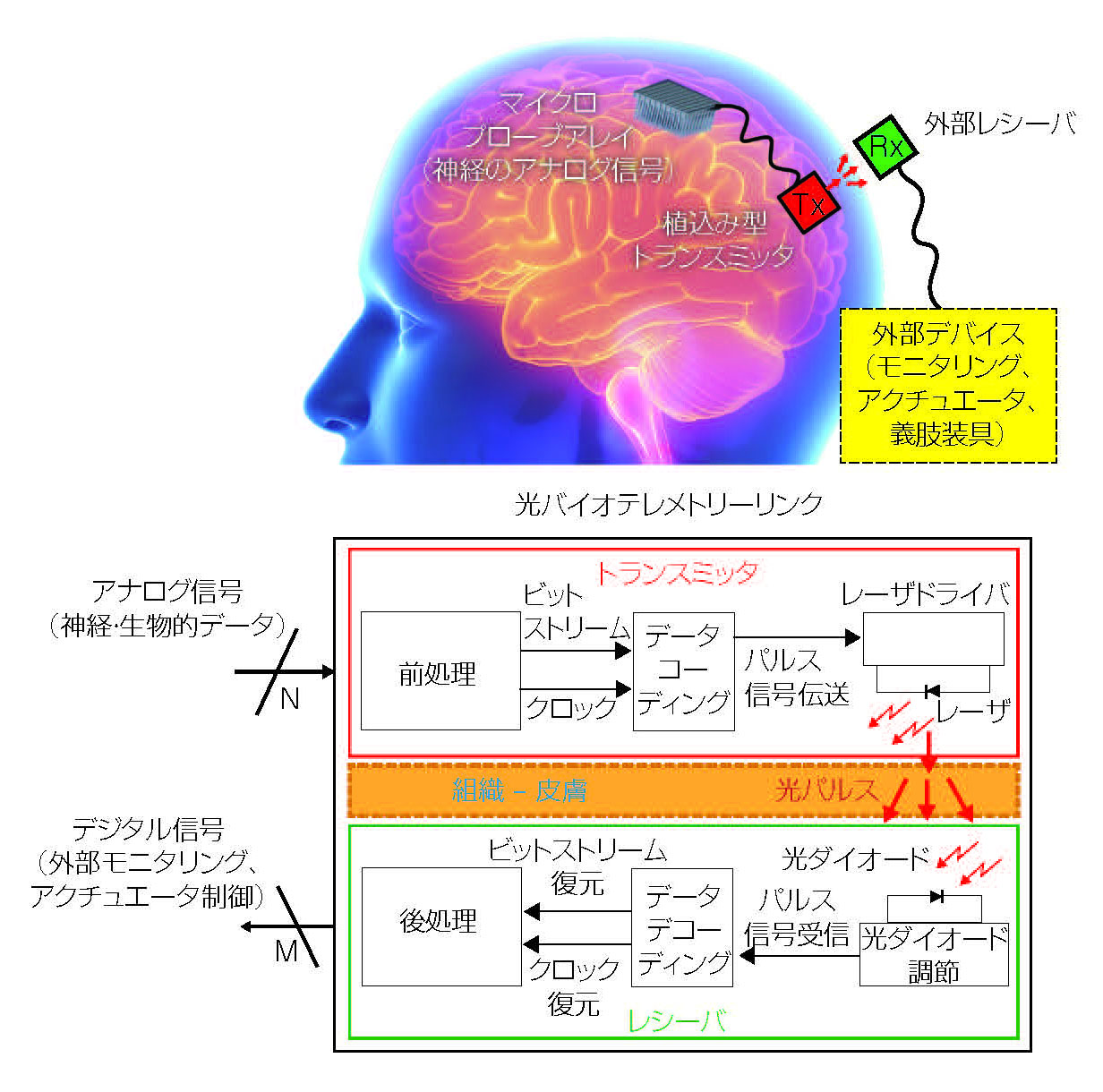
図1 超広帯域パルスデータコーディングに着想を得た光学データ伝送は、厚さ3.5mmのブタの皮膚を介して300Mbit/sで伝送できる性能を示した。
マウスから別のマウスへ
光技術はデータ伝送の速度と品質を向上させるが、神経シグナルを取得したり、その信号を有用な方法で利用したりすることには役立たない。中国国立生物科学研究所(National Institute of Biological Sciences)のミンミン・ルオ(Minmin Luo)研究室のルーホイ・リウ氏(Luhui Liu)とルイユ・ワン氏(Ruiyu Wang)は、この課題に劇的な方法で取り組んでいる。彼らは、1匹のマウスの運動領域からシグナルを取得し、別のマウスの脳を刺激して、2匹のマウスが同調して歩くようにした(4)。
ルオ氏のチームは、「マスター」マウスの運動制御部の神経細胞を光遺伝学的に改変し、Ca2+のインディケータであるGCaMP6を発現するようにした。特にターゲットとしたのはNucleus Incertus(NI)領域の神経細胞である。ここの神経細胞では、神経シグナル分子であるニューロメジンB(NMB)が発現している。先行研究で、これらの神経細胞が運動の指示などに関与していることがわかっていた。彼らはその後、光ファイバを植込み、脳領域に照射して追究した。GCaMP6が488nm光で励起されると、Ca2+イオンの存在下で高レベルの蛍光を発する。この蛍光が神経活動の指標となる。この装置をマウスの頭部に固定し、トレッドミルの上で自由に歩かせた。蛍光が明るくなるほど神経活動が高いことを意味し、動きが早いことと相関した。
さらにNI NMBの神経細胞を別のマウス(「アバター」マウス)で改変した。この改変は、先とは逆で、光によって神経活動が引き起こされるようになっている。具体的には、この神経細胞でチャネルロドプシン2(ChR2)が発現して光に反応するよう形質転換された。アバターマウスの脳にファイバを植込むとNIに照射できる。5、10、20、50Hzの周波数で488nmの光を5msパルスで照射すると、マスターマウスと同じようにデバイスを頭部に固定されたアバターマウスは、光の信号に応答してトレッドミルの上を歩いた(図2)。
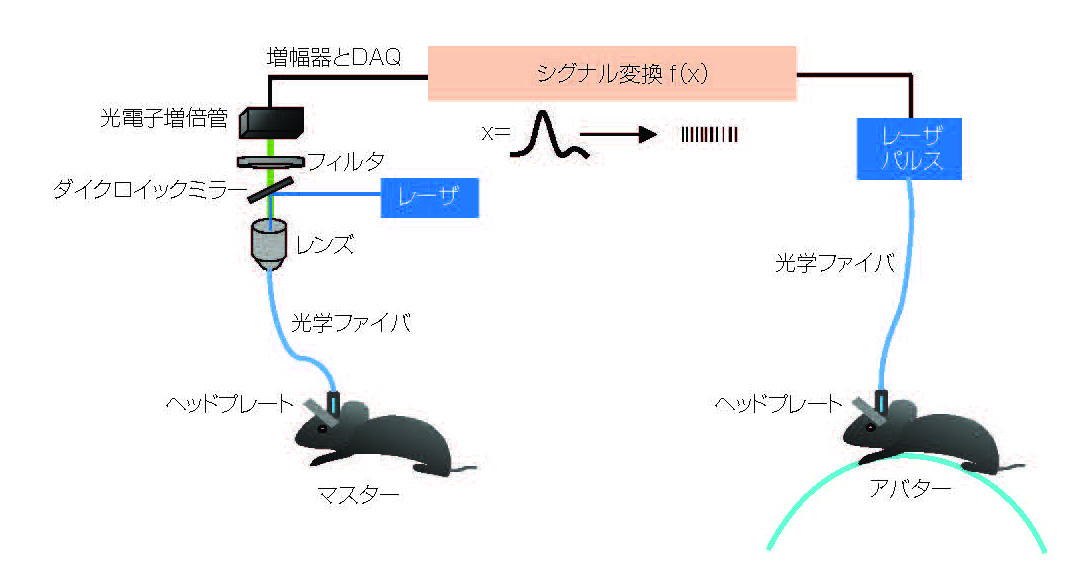
図2 神経活動時に蛍光を発するよう遺伝的に改変された「マスター」マウスの脳と、光で活性化するよう改変された「アバター」マウスの脳をつなげると、マスターマウスからのシグナルに応答してアバターマウスが動作する。
その後、研究チームは2つの成果をつなげた。マスターマウスからの光の強度を測定し、20~50Hzの周波数に変換してからアバターマウスに光信号を送った。これを14組のマウスで行い、20分間隔で測定した。マスターマウスがトレッドミルの上を歩き始めると、1.5メートル離れたアバターマウスが同じタイミング、同じ速度プロファイルで歩いた(図3)。
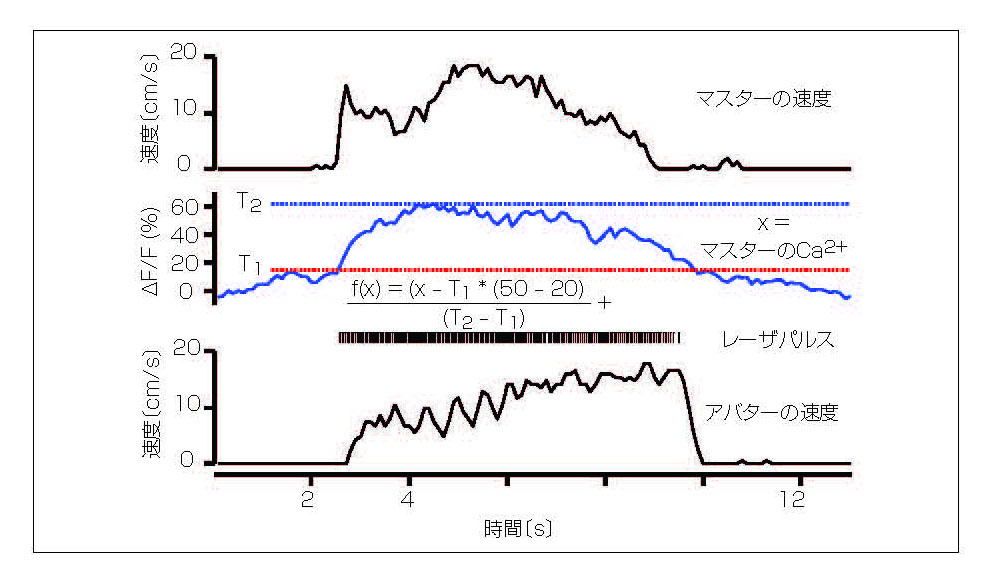
図3 マスターマウスの脳内で検出された蛍光は、アバターマウスの脳内で神経発火を誘発するパルスに変換される。すると、アバターマウスはマスターマウスの行動を投影する。
チームのポスドクであるルーホイ・リウ氏によると、「光による脳間インタフェース(BtBI)が、EEGによるBtBIで報告されている推定情報速度より、少なくとも2ケタ高い伝送速度で運動情報を伝送できることを我々は実証した」という。マスターマウスに複数のファイバを取り付け、共発現する光学プローブを追加すれば、旋回や後進を操作する信号など、より細かい運動制御信号を局在化できるかもしれない。今回の研究は将来的に、「他の個体の運動を完全に制御できるBtBI」が開発され、「種内で、あるいは種を超えて」利用できる可能性を切り開いたとリウ氏は述べる。
脳から直接
ここまで紹介した技術は、神経シグナルを作る何らかの外部メカニズムが脳の外でアクセス可能であることを示唆または要求している。しかし、脳そのものが内部シグナルを外部からアクセスできる場所に伝送できたらどうだろう。米ペンシルベニア大のD・ケイシー・カレン教授(D. Kacy Cullen)は、そのような方向性を持っている。複数の機関からなるチームの一員として彼らは、光遺伝学的に改変された神経細胞から「生きた電極」を開発した。これは、脳内の信号を皮膚表面に伝送できる電極だ。
カレン教授のチームは、胎児期のラットから大脳皮質細胞を採取して培養し、球状の凝集体にした。この凝集体を、外径398μm、内径180μmのハイドロゲル製の中空マイクロカラムの片端または両端に配置した。凝集体には、Ca2+レポーター遺伝子であるRCaMP1b、またはChR2活性化遺伝子が導入された。神経細胞はカラムの中に軸索を伸ばした(図4)。研究チームは、これらのマイクロ組織工学神経ネットワーク(μTENN)を2~9mmの長さで製作した。双方向性のμTENNでは、一端のChR2ニューロンを刺激すると、もう一端でRCaMP1bが発現する凝集体
の中で蛍光を発することが確認された(図5)。

図4 チャネルロドプシンが発現しているニューロン(左)と、GCaMPが発現しているニューロン(右)を中空ハイドロゲルチューブの端に設置すると、軸索が伸びてお互いに結合する。
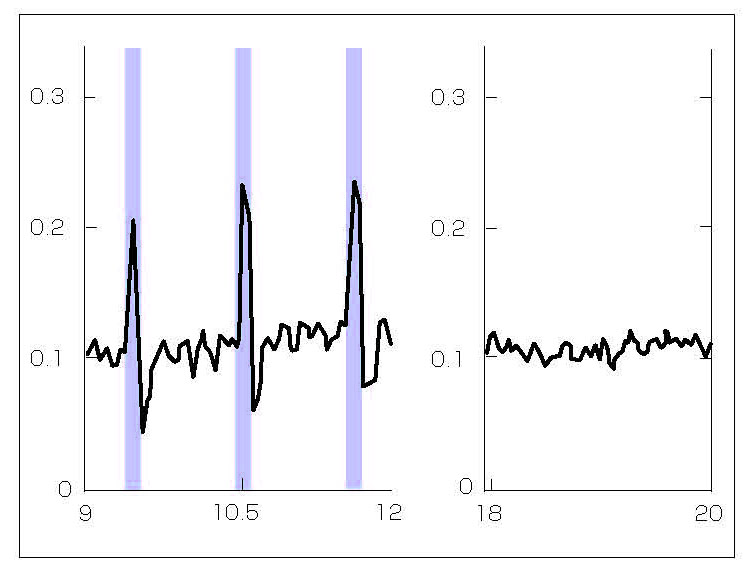
図5 縦の青いバーで示した「生きた電極」の片端の光パルスは、実線の黒のカーブで示した反対側のカルシウム応答を誘発する。
研究チームは、ラットの一次視覚野にμTENNを植込み、もう一端は頭蓋骨の表面まで伸ばして、密封窓で保護した。多光子顕微鏡を用いて、カルシウムが結合したRCaMP1bの蛍光によって神経活性を可視化できた。μTENNは少なくとも1ヶ月間は保持された。さらに劇的なことは、ラット脳を免疫組織化学的に調べると、μTENNニューロンは移植部位から数ミリメートル伸びており、ラット脳とシナプス形成していることの明確な証拠が得られた。
本研究は初期段階であるものの、いくつかの意味はすでに明らかになっている。μTENNが作る「生きた電極」は、脳内からの神経シグナルに表面から直接アクセスでき、将来の神経インタフ
ェースの基礎を築く。研究者らは、「複数の異なるμTENNを近接して成長させ、連携できれば、神経回路全体のシステムレベルのネットワークダイナミクスモデル化、操作、特徴付けが可能だろう」と結論付けている。
参考文献
(1) K. A. Moxon et al., Neuron, 86, 1, 55-67( 2015 ); doi:10.1016/j.neuron.2015.03.036.
(2) A. De Marcellis et al., IEEE Trans. Biomed. Circuits Syst., 1 4 , 3 , 4 4 1 -4 5 1 ( 2 0 2 0 );doi:10.1109/tbcas.2020.2972733.
(3) A. De Marcellis et al., Proc. IEEE, 1-5( 2020); doi:10.1109/iscas45731.2020.9180609.
(4) L. Lu et al., Sci. China Life Sci., 63( 2020); doi:10.1007/s11427-020-1675-x.
(5) D. O. Adewole et al., Sci. Adv., 7, 4, eaay5347( 2021); doi:10.1126/sciadv.aay5347.
著者紹介
リチャード・ゴーハンは、米マウンテンオプティカルシステムズ社のオーナー兼BioOptics Worldの寄稿記者。e-mail:rgaughan@mountainoptical.com














